公司提供的数据管理服务(DM服务),从普遍存在于CRO行业的效率模式升级为战略模式,不仅可以降低研发成本,而且还可以提高研发效率,缩短研发周期,加快新药上市速度。具体来说,在Ⅰ~Ⅳ期临床研究阶段,根据临床试验的特点,把各种类型的临床试验的共性抽离出来,形成客户认可的,公司独有的「标准操作流程(SOP)」,做到了产品差别化,有效推动研发的效率和产率的提升。
减少DM系统的定制部分,削减开发和检测费用,从整体上降低开发成本。缩短运营项目的准备时间。
减少不同试验的数据核查判断的特殊部分,增加共通核查判断的数量,让整体的质量趋于稳定。
不断积累项目过程中的错误判断的数据,基于对此大数据的统计分析,抽出质量管理(QC)的重点对象,进行质量监测,根据需要采取对策以改善质量。
根据上述积累的大数据,还可以检知数据核查判断的难易度,根据难易度配置人员。从而提高工作效率,降低人工成本。
数据管理计划
eCRF定义
数据验证计划
DB创建
逻辑检查编程
UAT
CRF录入指南
数据核查
Query管理
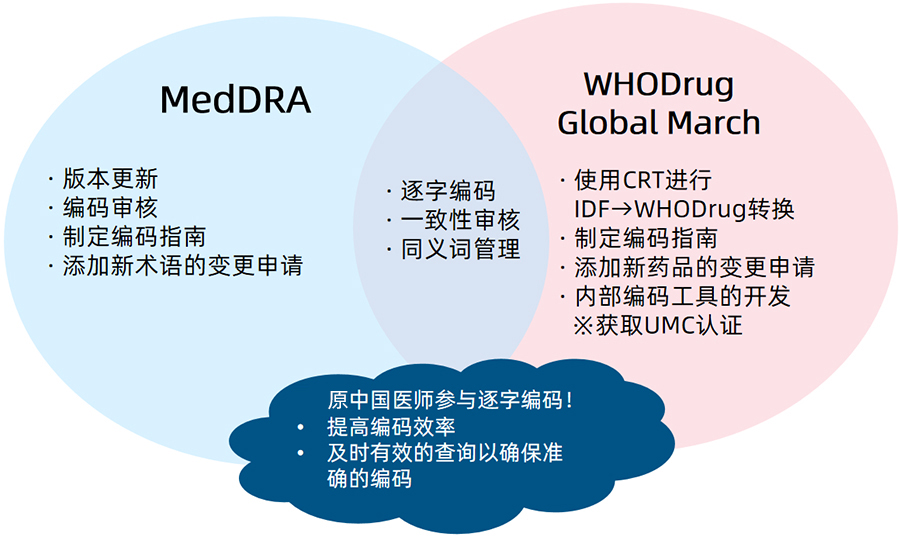
编码(MedDRA, WHO-DRUG)
SAE一致性核查
DBL
数据审核会议
数据管理报告
文件保管
※ Viedoc
✔ 分析高频率发生的queries,反馈容易出错问题处进行监控。
✔ 与临床共享数据入力进度并尽早调整 DBL 的资源。
✔ DBL前掌握临床中心的访视日程,及时发出queries并解决。
✔ 在DBL前向统计师提供数据,Dry run后。尽早发现有疑问数据。
✔ 根据数据录入和数据清理的进度,提议召开病例讨论会议的时间。
| 原则 | 详细 |
| 可归因的 Attributable | 数据应清楚地说明由何人观察并由何人记录,在何时被观察和记录,并且说明是关于什么的数据,可被溯源。 |
| 易读的 Legible | 采集的数据可被他人阅读和理解,不能被认读和理解的数据或术语缩写不应当被采用,因为任何不能被清楚地认读的数据或术语缩写可能造成误解,和被输入数据的人员错误地输入数据系统中。 |
| 同时的 Contemporaneous | 数据的实时记录伴随着数据的实时观察而完成,因为任何延滞数据的输入都可能造成数据记忆的偏差和错误。 |
| 原始的 Original | 原始数据应以原始格式获取并保存。第一次被记录或采集的数据为原始数据。 |
| 准确的 Accurate | 数据是正确的,真实的,有效的和可靠的,与实际操作一致,无主观造假或客观输入错误;数据的采集方法就符合方案要求。 |
| 完整性 Complete | 临床试验原始数据与原始资料的保存应完整无误。 |
| 一致性 Consistent | 与实际生成逻辑顺序一致;转录的数据与源文件一致。 |
| 持久性 Enduring | 任何临床试验电子文件的保留应当符合国家和申办方有关临床试验记录文档保留时限的规定,并在需要时可恢复,如CD,硬盘等。 |
| 可获取性 Available | 研究者收集的所有数据(包括数据质疑和数据变更轨迹记录)需要在临床试验进行期间随时在研究机构都可以被审阅和监查;在临床试验结束后的保存期限内,当药监部门和稽查人员需要审阅时能及时提供。 |